Por que a OMS mudou diretrizes de tratamento para pacientes graves?
Novos estudos confirmam: corticoides diminuem mortalidade em um terço. Mas podem prejudicar pacientes com sintomas leves
Publicado 03/09/2020 às 10:08 - Atualizado 03/09/2020 às 10:22
Este texto faz parte da nossa newsletter do dia 3 de setembro. Leia a edição inteira.
Para receber a news toda manhã em seu e-mail, de graça, clique aqui.
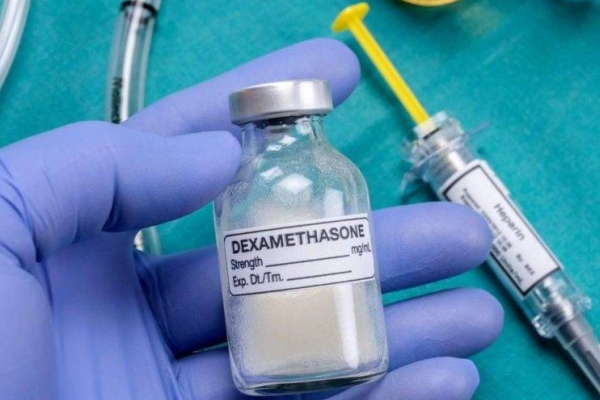
A OMS foi cautelosa quando o Recovery – o grande estudo clínico randomizado feito no Reino Unido para avaliar tratamentos contra a covid-19 em milhares de pacientes – mostrou bons resultados com a dexametasona. Isso aconteceu há dois meses, e na época a entidade prometeu coordenar um trabalho analisando todos os estudos disponíveis.
Essa análise saiu ontem, publicada no Journal of the American Medical Association. Foram avaliados sete estudos clínicos que envolveram 1,7 mil pacientes em 12 países, incluindo o Brasil. E os resultados foram positivos não apenas para a dexametasona, mas também para hidrocortisona e metilprednisolona. Os corticoides melhoraram as chances de sobrevida: o risco de morte foi reduzido em um terço, o que é bem significativo. Mas os ensaios só incluíram pacientes em estado grave – essas drogas suprimem o sistema imune e, nos casos leves, podem prejudicar a resposta do organismo. Além disso, podem deixar os pacientes vulneráveis a outras infecções.
Diante dos resultados, a OMS divulgou novas diretrizes recomendando que os corticoides se tornem o tratamento-padrão para pacientes em estado “grave e crítico”.
Uma observação: há meses (e principalmente desde os resultados do Recovery), vários países já vinham utilizando essas drogas e, mesmo onde não há recomendação oficial, a conduta é adotada individualmente por hospitais. Como o Brasil está sempre na contramão, o último documento do Ministério da Saúde com orientações para o manejo clínico de pacientes, publicado em junho, recomenda que os corticoides não sejam utilizados rotineiramente em pacientes graves.
Pequeno gigante
Os bons resultados dos corticoides – que são baratos, numerosos e acessíveis – acabaram apequenando o caríssimo remdesivir. O medicamento da farmacêutica Gilead vinha despontando desde o início do ano como possível droga promissora e os estudos preliminares com ele mostraram benefícios, embora modestos. Ele não salva vidas, apenas reduz o tempo de internação. Quando os hospitais estão abarrotados, sem dúvida é algo importante.
A droga ainda é experimental, está na fase 3 de testes. Porém, rapidamente os dados preliminares da Gilead levaram os Estados Unidos a aprovar, ainda em maio, seu uso emergencial para pacientes internados. No início, os frascos eram doados pela empresa; a partir de junho cada tratamento passou a custar até US$ 3,1 mil (ou R$ 16,7 mil). O país, cujo secretário de Saúde Alex Azar é ex-lobista da indústria farmacêutica, comprou quase toda a produção da Gilead até setembro. E agora acaba de estender sua autorização emergencial.
Para 127 países – ficaram de fora os considerados ricos, inclusive o Brasil – a Gilead liberou a patente. Mas isso não significa que o remédio tenha se tornado amplamente acessível. Uma matéria do Bhekisisa analisa o caso da África do Sul, onde a Cipla – empresa de genéricos que recebeu licença para fabricá-lo – vende o tratamento por até US$ 550 por pessoa. O problema é que os dados que embasam esse custo (como, aliás, acontece sempre com os medicamentos de marca) não ficam disponíveis.
Outras Palavras é feito por muitas mãos. Se você valoriza nossa produção, contribua com um PIX para [email protected] e fortaleça o jornalismo crítico.