A decisão da Anvisa sobre a CoronaVac em crianças
Área técnica considerou que não há dados suficientes para determinar perfil de segurança e proteção. Uso para essa faixa etária foi autorizado pela China em junho
Publicado 19/08/2021 às 08:13 - Atualizado 19/08/2021 às 08:15
Esta nota faz parte da nossa newsletter do dia 19 de agosto. Leia a edição inteira. Para receber a news toda manhã em seu e-mail, de graça, clique aqui.
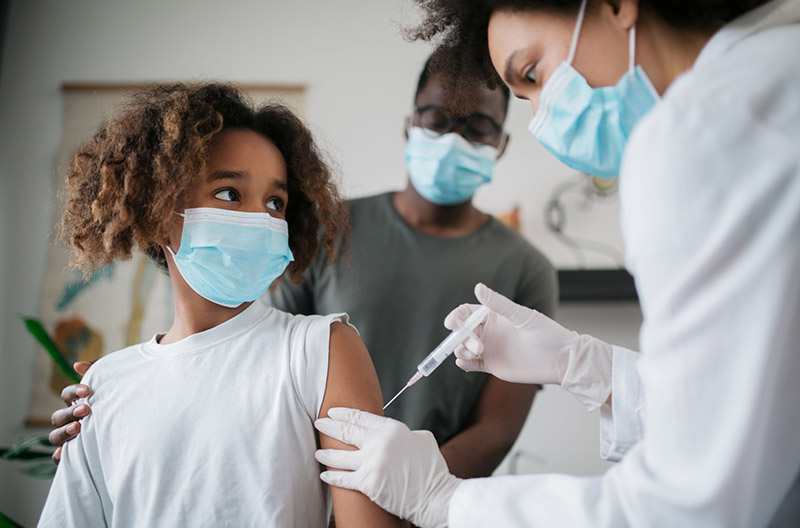
A Anvisa rejeitou ontem a autorização do uso da CoronaVac para o público entre três e 17 anos, pedida pelo Instituto Butantan. A decisão foi unânime e baseada na recomendação da Gerência-Geral de Medicamentos, segundo a qual os dados disponíveis não são suficientes para estabelecer o perfil de segurança nessa faixa etária, tampouco a proteção conferida pela vacina.
No fim de junho, foram publicados no The Lancet Infectious Diseasesos primeiros resultados da CoronaVac para este público. O ensaio de fase 1/2 envolveu 550 participantes, viu que a vacina induziu resposta imunológica mais forte do que em adultos e que a taxa de reações adversas foi muito baixa. Pouco antes da publicação, no início daquele mês, a China aprovou o uso da CoronaVac para pessoas acima de três anos, mas ele ainda não está disseminado. Agora, em agosto, o país lançou uma campanha de vacinação de adolescentes de 12 a 17 anos nas escolas.
Voltando à reunião: o gerente-geral de Medicamentos da Anvisa, Gustavo Mendes, apontou que ainda não há estudos confirmatórios (as fases 1 e 2 avaliam a resposta imunológica, determinam a dosagem e dão as primeiras indicações sobre segurança, mas não permitem determinar a eficácia nem confirmar a segurança em uma população mais ampla), e que o número de voluntários envolvidos até agora foi muito pequeno. Ele observou que, embora os dados demonstrem boa produção de anticorpos nessa faixa etária, isso não é suficiente para avaliar a proteção. Isso porque, nos adultos, os estudos ainda não apontam uma correlação causal entre uma coisa e outra.
Provavelmente, a questão principal é a segurança. Como a aprovação depende de um cálculo entre riscos e benefícios, e como para crianças os riscos representados pela covid-19 são bem mais baixos que para adultos, a segurança da vacina precisa estar ainda mais bem estabelecida. Até agora, em adultos, a CoronaVac é um dos imunizantes com menos efeitos adversos, o que é uma grande vantagem.
Um ponto que comprometeu o aval para crianças e adolescentes é que, segundo a Anvisa, o Butantan ainda precisa enviar algumas informações sobre a proteção da CoronaVac em adultos: por exemplo, o acompanhamento da resposta imune, eficácia e segurança dos voluntários que participaram do ensaio clínico de fase 3 não foi disponibilizado. Também faltam os dados sobre a pesquisa realizada em Serrana – que, apesar da divulgação preliminar à imprensa em maio, até hoje não saíram em lugar nenhum.
O Butantan disse que os dados de imunogenicidade não foram entregues na sua totalidade à Anvisa “por conta de divergências no método de análise“, e que, embora considere as informações fornecidas até agora satisfatórias, atenderá ao órgão.
No futuro, a decisão da Anvisa quanto à CoronaVac ainda pode mudar (e, por aqui, acreditamos que ela será uma vacina muito boa para crianças). Por enquanto, o único imunizante contra covid-19 liberado para menores de 18 anos no Brasil continua sendo o da Pfizer/BioNtech, a partir dos 12 anos. Seu ensaio de fase 3 com adolescentes envolveu 2,2 mil pessoas nos Estados Unidos.
Outra dose, sim
Também por unanimidade, os diretores da Anvisa aprovaram uma recomendação para que o PNI (o Programa Nacional de Imunizações) avalie aplicar uma dose de reforço, em caráter experimental, a grupos específicos vacinados com a CoronaVac – como idosos acima de 80 anos e pacientes imunocomprometidos. O Ministério da Saúde continua dando pistas de que isso vai acontecer, mas não há nada certo.
Esta nota faz parte da nossa newsletter do dia 19 de agosto. Leia a edição inteira. Para receber a news toda manhã em seu e-mail, de graça, clique aqui.
Outras Palavras é feito por muitas mãos. Se você valoriza nossa produção, seja nosso apoiador e fortaleça o jornalismo crítico: apoia.se/outraspalavras
