Hepatite C: o novo remédio e as oportunidades perdidas
Primeiro lote de sofosbuvir, que revoluciona tratamento da doença, foi entregue ao SUS pela Fiocruz. Mas o medicamento poderia estar sendo fabricado no Brasil há anos – não fosse a questionável patente concedida a uma farmacêutica dos EUA
Publicado 27/11/2023 às 12:03 - Atualizado 29/11/2023 às 16:01

No início deste mês, no dia 8/11, a Fiocruz entregou ao Ministério da Saúde (MS) o primeiro lote de sua nova produção de genéricos do sofosbuvir e daclatasvir, com 800 mil unidades dos fármacos, importantes medicamentos para o tratamento da hepatite C. Anteriormente monopolizado pela empresa farmacêutica estadunidense Gilead, o sofosbuvir agora também será oferecido por Farmanguinhos aos pacientes brasileiros. 300 mil casos da doença foram registrados no país nos últimos vinte anos – e indícios sugerem que muitos milhares mais vivem sem tratamento.
Como conta a farmacêutica e consultora do Grupo de Trabalho de Propriedade Intelectual (GTPI) Carolinne Scopel a Outra Saúde, a notícia pode ser um grande avanço para os pacientes brasileiros. Em relação ao tratamento anteriormente utilizado, baseado no interferon, a combinação dos dois medicamentos resulta em “mais de 90% de cura, funciona para todas as variações do vírus, os efeitos colaterais são muito menores e o tempo de tratamento, de 12 semanas, é bem mais curto”.
Além disso, com a produção local do medicamento, o país também deve se beneficiar de “uma economia importante para a sustentabilidade do Sistema Único de Saúde (SUS) como um todo”, diz a consultora. Uma parcela do orçamento da Saúde, sempre em disputa, deixará de ser enviada a uma grande companhia estrangeira. Mas o contexto maior sugere que seguem existindo limites claros na política de patentes farmacêuticas aplicada pelo Estado brasileiro.
O prolongado cabo de guerra em torno dos direitos patentários do sofosbuvir ajuda a ilustrar a questão. O embate envolveu pelo menos três idas e vindas de concessão e suspensão da patente no Instituto Nacional de Propriedade Intelectual (INPI) e na Justiça – e, ao fim, a Gilead recebeu a carta-patente do produto no Brasil. No cerne da disputa, recapitulada em detalhes por Outra Saúde, a ganância de uma empresa transnacional e a luta para que os brasileiros que vivem com hepatite C acessem um medicamento que pode lhes garantir a cura.
Aprova ou não aprova?
Em 2013, o sofosbuvir recebeu a aprovação da Food and Drug Administration (FDA), autoridade sanitária estadunidense, um sinal verde que costuma acelerar a adoção de medicamentos por outros países do mundo. Mesmo à época, ativistas estadunidenses alertavam que o preço do fármaco imposto pela Gilead era “inabsorvível pelo sistema de saúde e completamente injustificado”. Não muito depois, só no Brasil, a companhia fez dezenas de solicitações de patente relacionadas ao sofosbuvir – velha tática da indústria farmacêutica para bloquear a produção de genéricos e proteger seus lucros exorbitantes.
Naquele momento, explica Scopel, “a sociedade civil, incluindo o GTPI e a Abia [Associação Brasileira Interdisciplinar de Aid], e mesmo laboratórios públicos e privados, como Farmanguinhos e a Blanver, ofereceram subsídios técnicos à discussão, argumentando que aqueles pedidos de patente não deveriam ser concedidos”. A Agência Nacional de Vigilância Sanitária (Anvisa) se posicionou contra a patente, assim como o fez o Conselho Nacional de Saúde. A própria Fiocruz reforçou que, por meio de uma Parceria para o Desenvolvimento Produtivo (PDP), poderia oferecer o medicamento de forma a “garantir segurança sanitária com preços estáveis”.
Em 2018, o embate alcançou seu auge. Em setembro daquele ano, o INPI aceitou a patente. Logo na semana seguinte, a Justiça concedeu uma liminar derrubando a decisão, por entender que ela “não se coadunava com o interesse social, tecnológico e econômico do país, sob a ótica do Programa de Combate à Hepatite C mantido pelo SUS”.
Porém, três meses depois, um juiz do Distrito Federal anulou a liminar e restituiu a patente à empresa. Ao fim, “das 126 reivindicações de patente da Gilead, só duas foram concedidas”, lembra Scopel. Mas como não podia deixar de ser, depois da concessão da patente, o preço do medicamento subiu em 1.421%. A essa altura, a Gilead chegou ao ponto de pedir uma liminar para impedir outra empresa – que havia vencido pregão público anterior à concessão da patente ao oferecer o medicamento por um valor menor que a farmacêutica dos EUA – de entregar ao SUS um lote de sofosbuvir que já estava no caminhão, pronto para ser entregue.
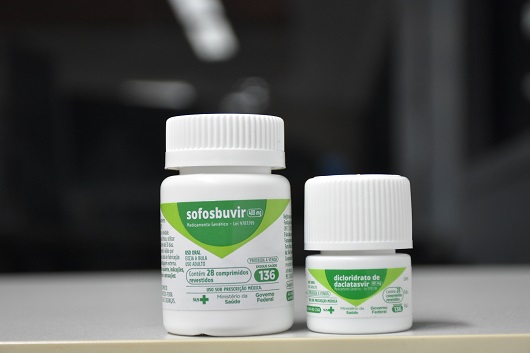
De lá para cá, “o Brasil se distanciou da meta de erradicar a hepatite C até 2030”, segundo avaliação dos Médicos Sem Fronteiras (MSF), e “os pregões mais recentes para a compra de medicamentos têm sido marcados pela ausência quase total de concorrência e pelo monopólio da empresa Gilead, que pratica preços cada vez mais elevados”. Em 2022, conta a consultora do GTPI, “o Brasil estava pagando mais de 7 mil reais por pessoa para o tratamento de 12 semanas para a combinação sofosbulvir e velpatasvir, enquanto internacionalmente essa combinação é vendida por 900 reais”.
Um detalhe da decisão de 2018, porém, abriu uma brecha para que farmacêuticas que não a Gilead fabricassem o medicamento: as duas patentes concedidas são ligadas a “uma substância intermediária na síntese do sofosbuvir”, e não ao fármaco em si, explica Scopel. Ao desenvolver, no contexto de um acordo de cooperação técnica com o Consórcio BMK, uma rota de síntese que não passa por esse intermediário para chegar ao Insumo Farmacêutico Ativo (IFA) do remédio, a Fiocruz finalmente pôde oferecê-lo ao SUS, como passou a fazer há três semanas – mas poderia estar fazendo há anos, não fosse a concessão da patente e uma denúncia da Gilead ao Tribunal de Contas da União (TCU), que bloqueou a continuidade do acordo.
Outros caminhos possíveis
O caminho de ação escolhido pelo Brasil, de uma espécie de cessar-fogo com a indústria farmacêutica ao não questionar sua patente, não era o único possível. Scopel cita pelo menos três. Um deles é a criação de uma PDP, com a farmacêutica promovendo, voluntariamente mas em geral com um longo prazo, a transferência da tecnologia necessária para a produção local do remédio. Uma segunda via seria a da busca de outros fornecedores internacionais além da Gilead. Outra forma ainda seria o licenciamento compulsório do remédio – a popular quebra da patente.
Diversos países, aliás, tomaram este último caminho. Países tão distintos quanto Egito, Argentina e China, por exemplo, não concederam os direitos patentários do sofosbuvir à Gilead. E se, em 2016, 10% da população egípcia sofria com a doença, hoje a hepatite C está praticamente erradicada na nação árabe – com uma contribuição decisiva do medicamento, livre da amarra das patentes. Em comunicado, a Organização Mundial da Saúde descreveu essa trajetória como “nada menos que impressionante” e ressaltou o papel da “produção local dos antivirais de ação direta”. Agora, o Egito está compartilhando seu sofosbuvir genérico com outros países da África, oferecendo tratamento gratuito para 1 milhão de pacientes.
Além disso, como nos lembra a quebra da patente do efavirenz pelo Governo Federal em 2007, essa alternativa não seria uma novidade para o Estado brasileiro. “O mecanismo da licença compulsória está previsto na legislação brasileira e nos acordos internacionais de que o Brasil faz parte”, frisa Scopel. Além disso, ela explica, “só a ameaça da emissão da licença compulsória também já serve como instrumento de negociação de preços com as farmacêuticas, e isso já aconteceu outras vezes”.
A capacidade científica da Fiocruz, no caso do sofosbuvir, conseguiu garantir – mesmo com atraso de alguns anos – preços mais baixos para o medicamento e, espera-se, a ampliação do acesso ao tratamento de qualidade para mais pacientes de hepatite C. Mas para afastar de vez a ameaça das doenças negligenciadas em um prazo razoável, é provável que o Brasil precise avaliar a possibilidade de seguir o caminho escolhido pelos países que tomaram medidas mais firmes frente às patentes farmacêuticas.
Outras Palavras é feito por muitas mãos. Se você valoriza nossa produção, seja nosso apoiador e fortaleça o jornalismo crítico: apoia.se/outraspalavras
